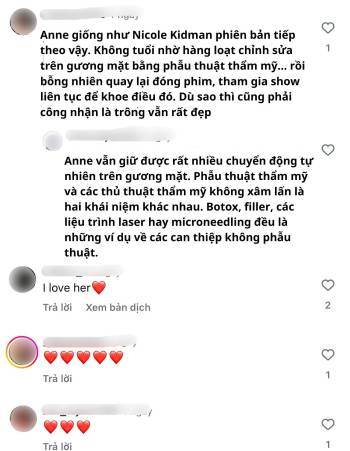
Trả lời VTC News ngày 25/9, ông Hoàng Hoa Sơn, Phó Chánh Văn phòng Chương trình sản phẩm quốc gia vaccine phòng bệnh cho người, nói, vaccine Nano Covax của Công ty Cổ phần Công nghệ sinh học Dược Nanogen (Công ty Nanogen) đang triển khai nghiên cứu thử nghiệm lâm sàng giai đoạn 3.
Bộ Y tế luôn tạo điều kiện cho nghiên cứu phát triển vaccine COVID-19 trong nước. Với Nano Covax, Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia (Hội đồng Đạo đức quốc gia) tổ chức nhiều cuộc họp đánh giá giữa kỳ kết quả thử nghiệm lâm sàng giai đoạn 3 (ngày 18/9/2021, 16/12/2021, 29/12/2021).
Bộ Y tế cũng tổ chức nhiều buổi làm việc trực tiếp và ra các văn bản đôn đốc Nanogen cùng nhóm nghiên cứu hoàn thiện báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 theo đề nghị của Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia và Hội đồng tư vấn đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
“Dự kiến cuối tháng 9/2022, Nanogen gửi hồ sơ bổ sung. Sau khi nhận đủ hồ sơ, Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia sẽ sớm tổ chức họp thẩm định, làm cơ sở để Nanogen hoàn thiện hồ sơ xin cấp phép”, ông Hoàng Hoa Sơn nói.
Cũng theo ông Sơn, việc cấp phép hay không cấp phép vaccine sẽ căn cứ trên hồ sơ đăng ký lưu hành và được thực hiện theo quy định, chứ không phải vì dịch được kiểm soát mà vaccine sẽ không cấp phép.
Một lãnh đạo Bộ Y tế từng chia sẻ với VTC News, do vaccine tiêm cho con người nên phải thận trọng, chỉ khi đủ bằng chứng về hiệu quả bảo vệ và độ an toàn khi sử dụng trên người thông qua nghiên cứu khoa học, khách quan, chúng ta mới đưa ra sử dụng cho người dân.
Hiện các vaccine này vẫn trong giai đoạn nghiên cứu thử nghiệm. Bộ Y tế đang đôn đốc đơn vị nghiên cứu đẩy nhanh tiến độ nghiên cứu sản xuất vaccine trong nước. Tuy nhiên, nếu được cấp phép lưu hành, việc sản xuất vaccine trong nước phải tính toán kế hoạch cụ thể để đảm bảo phù hợp nhu cầu sử dụng vaccine.
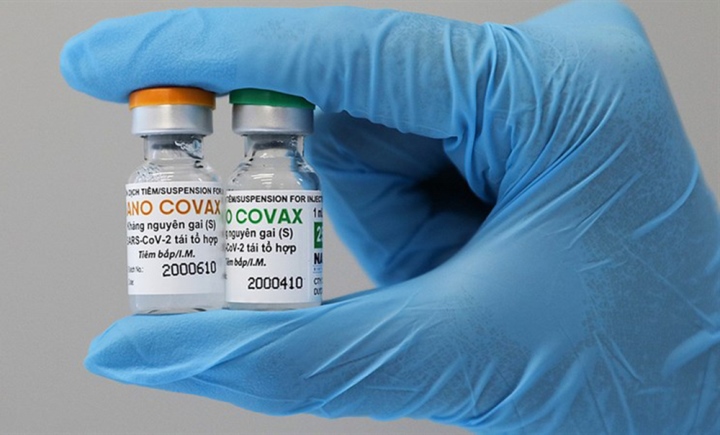
Nano Covax từng được kỳ vọng là vaccine "Made in Vietnam" đầu tiên.
Từng 2 lần qua "cửa" Hội đồng đạo đức
Vaccine phòng COVID-19 Nano Covax được Công ty Nanogen phát triển từ tháng 5/2020, dựa trên công nghệ protein tái tổ hợp. Trước khi thử nghiệm giai đoạn 3, vaccine này trải qua 2 giai đoạn thử nghiệm lâm sàng: Giai đoạn 1 bắt đầu từ ngày 18/12/2020, giai đoạn 2 từ ngày 26/2/2021 và giai đoạn 3 từ ngày 11/6/2021.
Tổng tình nguyện viên tham gia cả ba giai đoạn thử nghiệm vaccine là 13.620. Trong đó, 60 người thử nghiệm giai đoạn một, 560 người thử nghiệm giai đoạn hai, 13.000 người tham gia giai đoạn ba. Theo đề cương được phê duyệt, giai đoạn ba tiêm thử nghiệm Nano Covax nhằm đánh giá yếu tố hiệu lực bảo vệ của vaccine với cộng đồng và được thực hiện tại nhiều trung tâm trong nước với 13.000 người.
Tháng 6, Nanogen kiến nghị và mong Chính phủ ủng hộ để Nano Covax sớm được cấp phép khẩn cấp có điều kiện, mức giá khi ấy khoảng 120.000 đồng/liều. Kiến nghị này được Bộ Y tế đánh giá là "nóng vội".
Từ 20/8 đến 22/8/2021, sau khi xem xét, đánh giá hồ sơ và báo cáo, Hội đồng đạo đức họp và thống nhất chấp nhận kết quả thử nghiệm lâm sàng giai đoạn 3a với Nano Covax. Sau đó, hồ sơ và dữ liệu nghiên cứu của vaccine này được chuyển sang Hội đồng tư vấn để xem xét trước khi Bộ Y tế quyết định cấp phép khẩn cấp có điều kiện. Tuy nhiên, Hội đồng tư vấn không đồng ý thông qua vì hồ sơ thiếu một số nội dung. Hội đồng yêu cầu Nanogen và nhóm nghiên cứu tiếp tục bổ sung, làm rõ nội dung về chất lượng; hồ sơ dược lý, lâm sàng; tính an toàn; tính sinh miễn dịch và hiệu quả bảo vệ.
Tháng 9, Hội đồng đạo đức họp sau khi Công ty Nanogen bổ sung hồ sơ. Dù tiếp tục thông qua dữ liệu báo cáo bổ sung của Nanogen, Hội đồng vẫn yêu cầu Nanogen bổ sung đánh giá về hiệu lực bảo vệ của vaccine dựa trên số người mắc COVID-19 trong nghiên cứu.
Ngày 16/12, Hội đồng Đạo đức tiếp tục họp xem xét, đánh giá báo cáo cập nhật, bổ sung kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 Nano Covax với kết quả nghiên cứu tính đến ngày 30/11/2021. Hội đồng đánh giá Nano Covax đạt yêu cầu về tính an toàn, tính sinh miễn dịch, nhưng tiếp tục yêu cầu công ty bổ sung hiệu quả bảo vệ của vaccine.
Như vậy, sau gần hai năm, vaccine Nano Covax vẫn ở khâu bổ sung báo cáo cập nhật tiến độ và số phận của vaccine, chờ cơ quan chức năng xem xét cấp phép khẩn cấp.
Liên quan vấn đề này, một thành viên của Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia cho hay, dù Hội đồng Đạo đức đề nghị Nanogen và nhóm nghiên cứu hoàn thiện báo cáo nhưng "thời gian qua không hiểu vì lý do gì họ không bổ sung".

Tiêm thử nghiệm vaccine Nano Covax hồi tháng 6/2021.
Số phận các vaccine nội khác ra sao?
Trong báo cáo gửi Thủ tướng ngày 11/8 về tình hình tiếp nhận, triển khai tiêm chủng vaccine COVID-19 và về tình hình sản xuất vaccine phòng COVID-19 trong nước, Bộ Y tế cho biết về các ứng viên đang được nghiên cứu, thử nghiệm lâm sàng.
Với COVIVAC, ngày 20/4, Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia đã họp thẩm định đề cương nghiên cứu giai đoạn 3. Hội đồng đã xem xét hồ sơ, đề cương và có Giấy chứng nhận chấp thuận đề cương nghiên cứu Bộ Y tế đang tiếp tục chỉ đạo các đơn vị chuyên môn tổ chức hội thảo xin ý kiến các chuyên gia, các đơn vị để khi điều kiện phù hợp có khuyến cáo về hướng đi tiếp theo đối với ứng viên này.

Vaccine COVIVAC.
Vaccine ARCT-154: Ngày 20/4, Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia họp đánh giá báo cáo kết quả giữa kỳ giai đoạn I/II/IIIa/IIIb. Tổ chức nhận thử và nhóm nghiên cứu tiếp thu hoàn thiện hồ sơ báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn I/II/IIIa/IIIb vaccine ARCT-154 phiên bản 5.0 ngày 9/5 và được Hội đồng đạo đức trong nghiên cứu y sinh học quốc gia chấp thuận bằng giấy chứng nhận.
Vaccine COVID-19 HIPRA: Đã hoàn thành tiêm mũi 1 cho 256 người tình nguyện thử nghiệm lâm sàng giai đoạn IIb với 2 liều cơ bản, dữ liệu nghiên cứu, mẫu bệnh phẩm nghiên cứu đã được chuyển về Tây Ban Nha để phân tích kết quả. Hoạt động nghiên cứu tại Việt Nam vẫn đang được triển khai theo đúng đề cương đã được Bộ Y tế phê duyệt.
Vaccine S - 268019 của Shionogi: Nghiên cứu triển khai giai đoạn III tại 15 tỉnh. Số lượng người tham gia nghiên cứu đã tiêm mũi 1 là 9.870 người, đã tiêm mũi 2 là 9.090 người. Nghiên cứu đang được triển khai theo đúng tiến độ, nội dung của đề cương nghiên cứu được Bộ Y tế phê duyệt và sẽ kết thúc vào tháng 12/2023.
Đến ngày 25/9, khoảng 260 triệu liều vaccine được tiêm ở Việt Nam. Trong đó, số liều tiêm cho người từ 18 tuổi trở lên là hơn 220 triệu liều.
Bộ Y tế đã cấp phép sử dụng đối với 8 loại vaccine COVID-19 bao gồm: AstraZeneca, Gam-COVID-Vac (SputnikV), COVID-19 vaccine Janssen (Johnson & Johnson), Spikevax (COVID-19 vaccine Moderna), Comirnaty (Pfizer - BioNTech), Vero Cell (China National Biotec Group (CNBG)/ Sinopharm), Hayat-Vax và Abdala.